| GPCR结合动力学分析 |
概述:G 蛋白偶联受体 (GPCR) 包括了一大类完整的膜蛋白,对于跨质膜转导细胞外刺激以引发分子和细胞反应至关重要。 它们调节真核生物的各种生理过程,有超过 30% 的药物可用靶向 GPCR。但众所周知,膜蛋白的研究存在许多阻力,因为它需要模拟膜的环境,因为一旦从细胞膜中提取,它们稳定性便得不到保障。 在这里,我们展示了 WAVE RAPID以分辨率表征肽配体激动剂 (NTA11) 与神经降压素受体 1 (NTSR1)[1]相互作用的结合动力学。 该神经降压素GPCR 介导多种功能,例如低血压、高血糖、体温过低、抗伤害感染以及调节肠道运动和分泌 [2]。
材料与方法
受体GPCR蛋白通过 avi 标签在体内生物素化并被链霉亲和素预包被的传感器捕获 (WAVEchip DXH-S)。检测的肽激动剂是一种突变和截短形式的神经降压素,其包含Y11A 的13个残基 (Mw 725 Da)。 浓度为 300 nM, 3 倍稀释7 种不同浓度的分析物。 流速设置为 30 μL/min。 运行缓冲液为 50 mM Tris pH 7.5、150 mM NaCl 和 0.1% (w/v) 的表面活性剂月桂基麦芽糖-新戊二醇 (L-MNG)[3] . 所有检测均为 在 25°C 下进行。
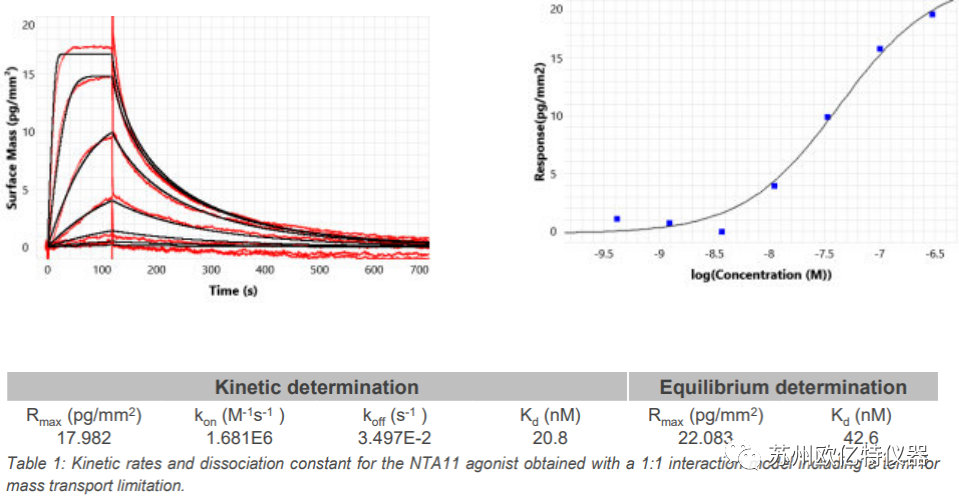
图 1:分析物为神经降压素肽 (Mw 725 Da) ,GPCR(神经降压素受体NTSR1,70 kDa 蛋白质/去污剂复合物)作为配体,上图为配体和分析物之间相互作用的传感图。 数据拟合用 1:1相互作用(扣除物质迁移效应)模型。
结果
生物素化并经过纯化的神经降压素受体被链霉亲和素预包被的传感器捕获 (WAVEchip DXH-S) ,其密度为 1350 pg/mm2。 其与肽激动剂结合的剂量反应曲线(图 1),得到的动力学曲线在1:1 相互作用(物质迁移)模型可以得到很好的拟合。表1中包含了动力学数据和平衡拟合数据。
参考文献
[1] Egloff, P., Hillenbrand, M., Klenk, C., Batyuk, A., Heine, P., Balada, S., Schlinkmann, K. M., Scott, D. J., Schütz, M., and Plückthun, A. (2014) Structure of signaling-competent neurotensin receptor 1 obtained by directed evolution in Escherichia coli. Proc. Natl. Acad. Sci. U. S. A. 111, E655–62.
[2] Krumm, B. E., and Grisshammer, R. (2015) Peptide ligand recognition by G protein-coupled receptors. Front. Pharmacol.
[3] Chae, P. S., Rasmussen, S. G. F., Rana, R. R., Gotfryd, K., Chandra, R., Goren, M. a, Kruse, A. C., Nurva, S., Loland, C. J., Pierre, Y., Drew, D., Popot, J., Picot, D., Fox, B. G., Guan, L., Gether, U., Byrne, B., Kobilka, B., and Gellman, S. H. (2010) Maltose-neopentyl glycol (MNG) amphiphiles for solubilization, stabilization and crystallization of membrane proteins. Nat. Methods 7, 1003–1008.